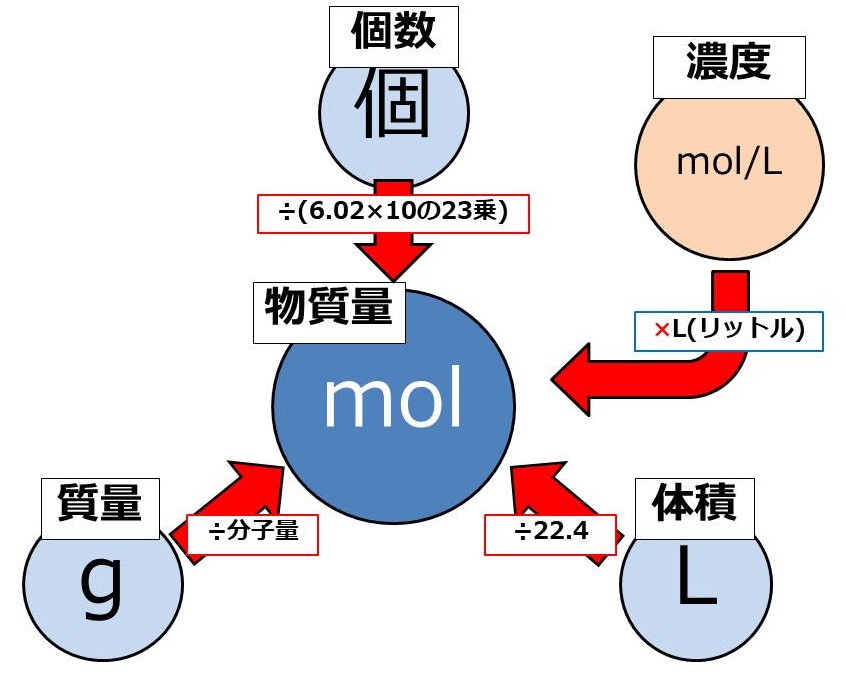
mo���ƕ��q�ʂ̊W
mol�Ƃ͈�̉��Ȃ̂��A�O�y�[�W(mol�Ƃ͂�����������)�ʼn�����܂����B
�܂��ǂ�ł��Ȃ��āAmol���킩��Ȃ��Ƃ������͓ǂ�ł݂Ă��������B
����ł͂��̃y�[�W�ł͎�����q���ɂ��ĉ�����܂��B
���̓��e���A���w�ɕK�{�̓��e�Ȃ̂ł��Ѓ}�X�^�[���Ă��������B
�������K�����܂��ƁAmol(������)�Ƃ͕��q�̐���\���P���ł����B
���w���������l����Ƃ��ɂ́A���̒P�ʂ͂ƂĂ��֗��ł��B
���������ۂ̎����̏�ł́A���ꂾ���ł͍����Ă��܂��܂��B
���q�╪�q�̏d���͎�ނɂ���ėl�X�ł�����A���ۂɔ��������ǂꂭ�炢�p�ӂ�������̂����킩��܂���B
�܂������q�̐��𐔂���킯�ɂ͂����܂���B
�Ⴆ�ΕĂ�50,000�������1kg�Ƃ����悤�ɁA���炩�������q�̐��Əd���̊W���킩���Ă��Ȃ��Ƃ����܂���B
���̂��߂ɑ��݂���̂��A���q�ʂƂ����l�ł��B
���q�ʂƂ�
���q�ʂ́A���q��1mol�����艽g�Ȃ̂���\���l�ł��B
�Ⴆ�A�Y�f�iC�j�̌��q�ʂ�12�ł��̂ŁA�Y�f���q��1mol������12g�A�Ƃ����悤�ɂȂ�܂��B
���̂��Ƃ� C��12 �Ƃ������ɏ����܂��B
���R�Y�f2mol�ł́A12�~2��24g�ł��ˁB
���q�ʂ�����������W�ɂ͕K���ڂ��Ă���̂ŁA�o����K�v�͂���܂����B
(���W�ɂ���ẮA�ŏ��̕��̃y�[�W�ɂ܂Ƃ߂čڂ��Ă���̂Œ��ӂ��Ă�������)
�o���Ă���l���������܂����A�킴�킴�o�����Ƃ��������g���Ă��邤���Ɋo���Ă��܂����l���唼���Ǝv���܂��B
�ꉞ�O�̂��߂Ɏ�Ȍ��q�ʂ��ڂ��Ă����܂��ƁA
H��1
C��12
N��14
O��16
S��32
���ꂭ�炢�o���Ă����A���Ƃ͖��ɍڂ��Ă���\���Q�Ƃ��Ȃ���ŏ\���ł��B
�����܂ł킩���Ă��܂��A���q�̏d�������߂�̂͂����ȒP�ł��B
�Ⴆ�ΐ����q�ł���A���f���q2�Ǝ_�f���q1�ŏo���Ă���̂ŁA���ʂ͍��v������߂��܂��B

���̒l�̂��Ƃq�ʂƂ����܂��B
����Ő����q��1mol��18g�Ƃ������Ƃ��킩��܂����B
�t�ɁA����36g����Ƃ��́A���q��36��18��2mol������Ƃ������Ƃł��B