mol(モル)の計算と公式①【感覚で簡単に考える化学】
mol(モル)計算の解説シリーズです。
今回はmol(モル)を求める計算だけに注目してみましょう。
molを極めれば、化学の基礎は攻略したようなものです。
mol(モル)は個数の単位
少し復習から入りましょう。
mol(モル)とは分子の個数の単位のことでした。
分子の数はとても多いので、一個二個と数えずに1モル、2モルと数えます。
ちなみに、皆「モルを求める」と言いますが、本当は「物質量を求める」と言うのが正しいです。
「リットルを求める」ではなく、「体積を求める」が正しいのと同じです。
ただ、物質量という言葉はちょっと分かりにくいので、このページでは「mol(モル)を求める」としていきます。
mol(モル)を求める式
molを求めるためには、次の図をマスターすることが大切です。
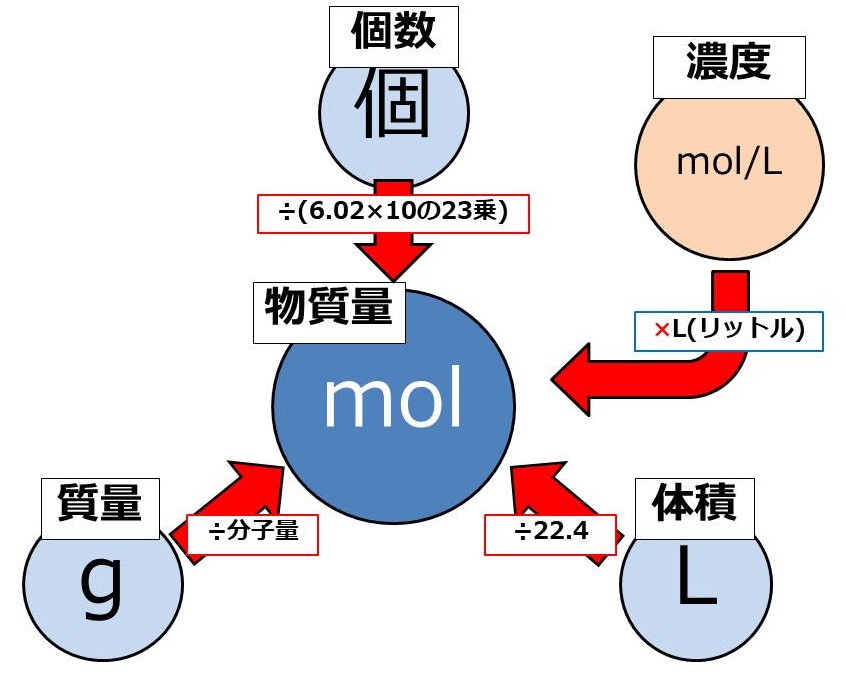
質量(g;グラム)、分子の個数(個)、気体の体積(L;リットル)のそれぞれの間にあるのが、mol(モル)という単位です。
必ずこのmolを通らないと計算が出来ないようになっています。
さて、molをどのように求めるのかというと、次の4パターンが基本です。
ひとつだけ掛け算なので、注意してください。
一つ一つ解説していきましょう。
分子量は1molあたりのg(グラム)
mol(モル)は分子の数の単位でしたね。
分子というのは1個あたりの重さが、種類ごとに決まっています。
1個あたり何gと言われても軽すぎるので、1molあたり何gなのかで数えます。
これが分子量です。
例えば、H2O(水)の分子量は18です。
これは水1molで18gあるという意味です。
もし水が36gあったら、
36(g) ÷ 18(分子量) = 2mol
と求めることができます。
molを求める計算の半分くらいはこれで求めます。
どんな気体も、1molあたり22.4L
この計算は気体の計算だけです。
絶対に溶液に使わないでください。
気体のL(リットル)にしか使うことができません。
ただし、気体であれば、どんな気体でも、同じ計算が使えます。
気体の体積(L)を22.4で割り算すると、molになります。
窒素も、酸素も、二酸化炭素も、全て同じ計算です。
例えばCO2の気体が5.6Lあったら、
5.6(L) ÷ 22.4 = 0.25mol
と計算できます。
また、水蒸気の計算でも同じ計算です。
水は水でも、水蒸気は気体なので同じ計算ができますよ。
スポンサードリンク
溶液の濃度(mol/L)から求めるときは、かけ算
少し単元が進むと、特に化学基礎の場合は、溶液の計算ばかりになります。
水酸化ナトリウム水溶液、というように溶液と書いているものもありますが、塩酸、希硫酸なども溶液のことなので注意しましょう。
さて、多くの溶液の問題ではmolではなくモル濃度(mol/L)を使います。
ここからmolを求めるためには、その溶液のL(リットル)が必要です。
大体の場合は、500mLというようにmL(ミリリットル)で書いているので、L(リットル)になおしてから使います。
1000で割るだけなので、なおし方は簡単ですね。
例えば、2mol/Lの溶液が300mLある場合、
300mL ÷ 1000 = 0.3L
2mol/L × 0.3L = 0.6mol
というふうに求めます。
かなりの頻度で登場するので、必ずマスターして下さい。
化学基礎の場合はg(グラム)から求める計算と、半々くらいの割合で使います。
個数からmolを求めることはあまりない
最初の習いたての頃は、
1mol = 6.02 × (10の23乗)個
6.02 × (10の23乗) :アボガドロ定数
と覚えさせられるのですが、その割には登場頻度が低いです。
なので、③の計算はあまり使うことがありません。
ただ、もしものために、余力があれば覚えておきましょう。
例えば、分子が3.01×(10の22乗)個あったら、
3.01×(10の22乗) ÷ 6.02×(10の23乗) = 0.0500mol
と求められます。
まとめ

mol(モル)を求める計算をマスターすれば、molについてはわかったも同然です。
あとは次の記事で、逆にmolから出発する計算を学べば、免許皆伝です!
苦手になる前に、教材を買うのもオススメ
化学のmolの単元で詰まってしまうと、この先の化学の内容が全然わからなくなってしまいます。
そして、化学が嫌いになってしまうのです。
そうなる前に、学校よりもわかりやすくて、簡単な教材で勉強しておくことをおススメします。
キラいになってしまってからでは、手遅れになってしまう可能性があります。
『とってもやさしい化学基礎』という教材は、化学が苦手な人向けに作られた参考書です。
化学アレルギーの人でもわかるように、やさしく書かれています。
ぜひ一度、のぞいてみてください。
ひょっとすると、いきなり化学が得意になってしまうかもしれません。
 |
|




