mol(モル)の計算と公式②【感覚で簡単に考える化学】
mol(モル)計算の解説シリーズ続編です。
今回は前回と逆に、mol(モル)を使う計算について考えてみましょう。
mol(モル)を使う計算も同じ図で考える
前回の図を覚えていますか?
molを求めるためにどんな計算をすればいいかをまとめた図を載せていました。
復讐のためにもう一度見てみましょう。
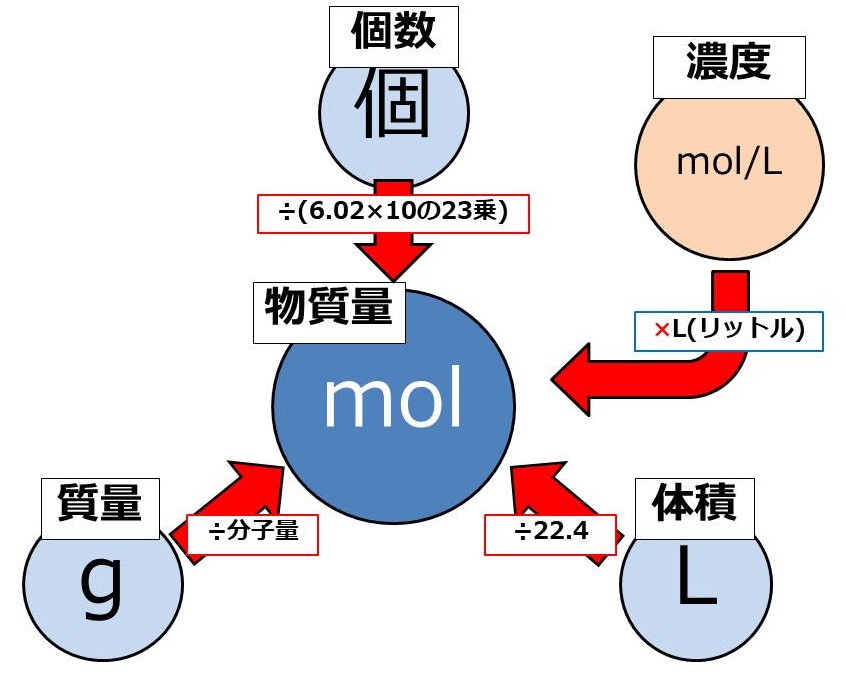
前回も言いましたが、mol(モル)という単位は中央にあるので、他の単位の計算をするときの多くでモルを通ることになります。
また、化学反応式の計算もモルを使います。
今回は、先ほどの図の矢印を逆にしたものから確認しましょう。
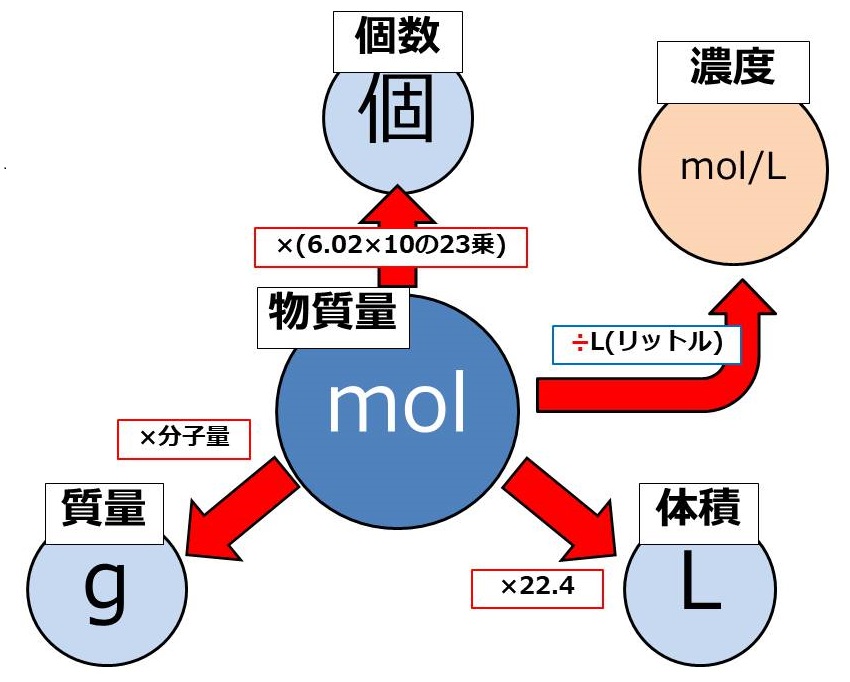
4つの矢印を逆にしました。
もちろん、計算も逆算になるので注意してください。
今回はかけ算が多く、1つだけ割り算です。
以下が公式ですね。
また一つ一つ見てみましょう。
分子量は分子1molあたりのg(グラム)
前回の繰り返しになりますが、分子には種類ごとに重さが決まっています。
分子1molで何gなのかが分子量です。
例えばCO2(二酸化炭素)の分子量は44。
CO2がもし3molあれば、
3(mol) × 44(分子量) = 132g
と質量を求めることができます。
二酸化炭素0.5molなら、×44して、22gですね。
めちゃくちゃよく使う計算です。
必ずマスターしてください。
気体はどの種類でも、1molあたり22.4L
これも前回の繰り返しですね。
というより、この記事の内容はほとんど前回の内容の繰り返しです。
逆算するだけですからね。
さて、タイトルにも書きましたが、気体は1molで22.4Lです。
これは気体だけのルールです。
化学基礎が終わった次の化学ではこのルールは通用しないので注意が必要ですが、ひとまずは1mol=22.4Lと覚えておきましょう。
くどいですが、気体だけの法則ということを忘れないでください。
溶液の濃度はmol(モル) ÷ L(リットル)
ここでのL(リットル)は気体の体積ではありません。
溶液、例えば塩酸や水酸化ナトリウム水溶液などの、全体の体積ですね。
この体積はmL(ミリリットル)で書かれていることが多いので、必ずLに直して計算しましょう。
これは前回と同じですね、1000で割り算してください。
例えば、0.6molの水酸化ナトリウムを水に溶かして300mLにするとき、
300ml ÷ 1000 = 0.3L
0.6mol ÷ 0.3L = 2mol/L
と濃度を求められます。
この計算もかなり使いますね。
スポンサードリンク
化学反応式の比から、他の物質のmolも出せる
この内容については計算が少し複雑になるので、別ページで解説します。
まとめ


この2つの図をマスターすれば、化学基礎の基本はかなり出来るようになります。
公式として覚えてしまってもいいですが、mol(モル)は公式を覚えるよりも理解をしておかないと後々痛い目に遭いますので、ぜひ理解することを心がけてください。
化学反応式の計算まで出来るようになれば化学アレルギーも治っちゃうので、もし余力が出てきたらそこまで頑張って勉強してみましょう。
 |
|




