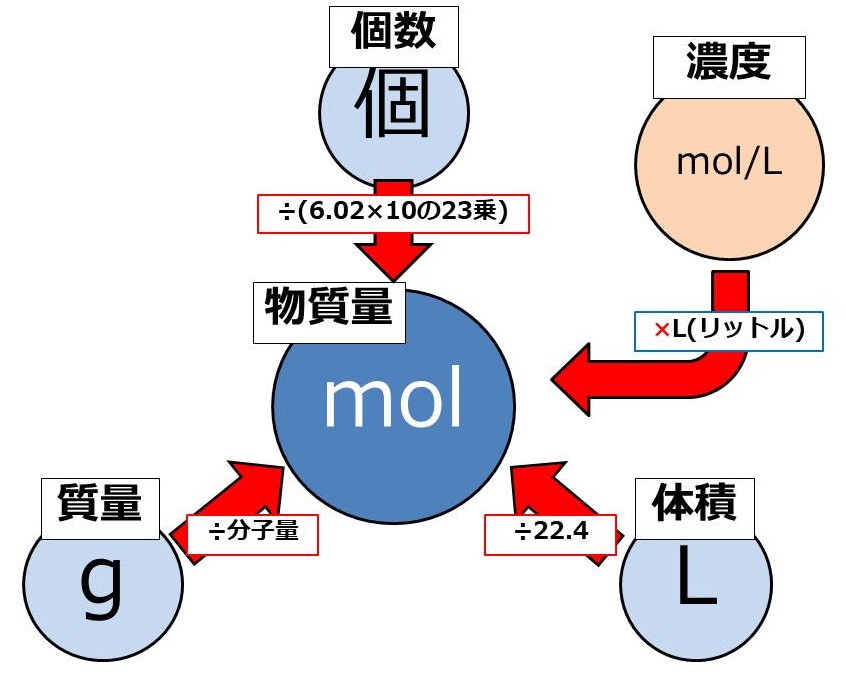
化学反応式の正しい計算
化学反応式は全ての単元で必要
化学反応式の計算問題は、高校化学のどの単元に進んでも存在します。
しかし、多くの人が計算方法を誤っているために、間違えてしまいます。
ここでは化学反応式の正しい計算方法を習得しましょう。
化学反応式の係数=変化量の比
次の化学反応式を考えてみましょう。
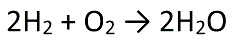
この反応式の意味は、水素分子2molと酸素分子1molが反応して、水分子2molが出来るという意味でした。
大切なのは、この係数の比は変化量についてのみ成立しているということです。
計算が出来ていない人の多くに共通するのが、以下のことを意識できていないことです。
化学反応式の計算を考える際には、必ず次の三つのことを考えてください。
反応前の量[mol]
変化量[mol]
反応後の量[mol]
[mol]と表記しましたが、反応式は元々分子の数についての式なので、質量[g]などではいけません。
必ず[mol]で考えるようにしましょう。
これだけではわかりにくいので、次の例を考えてみましょう。
例題
水素8gと酸素96gを密閉容器に封入し、完全に反応を進行させて水を生成した。反応後の容器に含まれる物質とその質量を求めよ。(H=1.0, O=16)
この問題は反応が起こっていますので、当然化学反応式の問題となります。
この問題を解くために、先程言った三つのことを意識して考えていきます。
反応前の量というのは、この問題の場合は与えられているのでそれがそのまま当てはまります。
(問題によってはここが未知数になることもあります)
水素と酸素の分子量はそれぞれ2、32ですので、まずは質量[g]を[mol]に直すと、
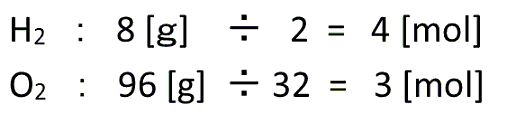
となります。
これが反応前の量です。
ここで再度問題文を見て下さい。
「完全に反応を進行させて」とありますよね?
これは、反応物のうち何か一つが尽きるまで反応が進むということです。
つまり、材料不足に陥るまでは反応が進みます。
ここからわかることは、反応後は水素か酸素、もしくはその両方が完全に無くなっているということです。
今、水素は4mol、酸素は3molありますが、もし酸素が全部反応しようとすると水素は6mol必要になるので、酸素を使い切ることはできません。
なのでここでは水素が使い切られるような状況を考えればいいのです。
ここまでを図に示すと、以下のようになります。
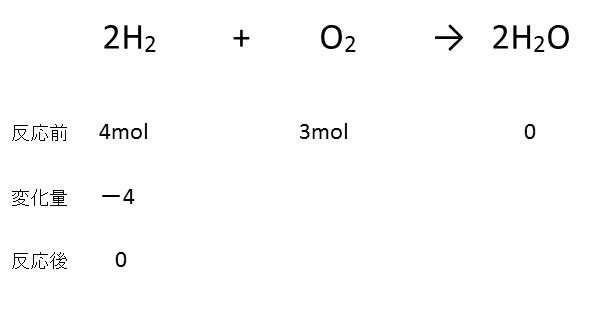
あとはこの図を完成させれば、この問題は解けることになります。
先程言ったとおり、変化量は反応式の係数の比に従います。
よって、以下の通りになることがわかります。
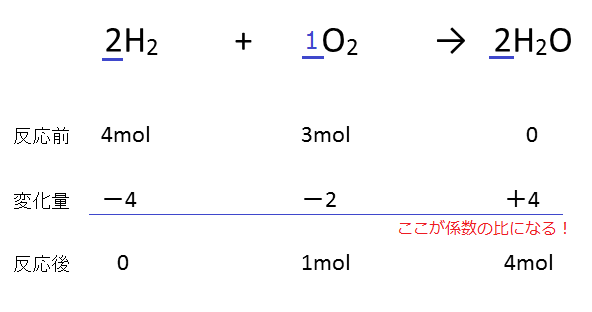
反応後の容器には酸素が1molと水が4mol存在するので、これを質量に戻して、
酸素 1[mol]× 32 = 32[g]
水 4[mol]×18 = 72[g]
これでこの問題はOKです。
問題はここまでですが、ここで両辺の質量に注目すると、質量保存の法則が成り立っていることがわかります。
覚えていなくても問題に答えられますが、計算が合っているかの確認にもなりますのでぜひ覚えておいてください。