mol(����)�Ƃ͉��Ȃ̂��ȒP�ɐ������Ă݂��y���o�ŊȒP�ɍl���鉻�w�z
���w�����Ȑl�̑����́A������(mol)�̂��Ƃ������킩�炸�Ɍ��ɂȂ��Ă��܂��܂��B
�������A����mol�̂��Ƃ��킩��Ȃ��ƁA���̐�̉��w�̒P���͂قƂ�ǂ킩��Ȃ��B
����ʼn��w�S�̂��킩��Ȃ��A�ƂȂ��Ă��܂��܂��B
�������t�Ɍ����A����mol�𐳂�����������Α��̒P���̂��Ƃ����ɂ킩��₷���Ȃ��Ƃ������Ƃł��B
�܂��͂��������Ƃ����l��������������Ɛg�ɕt���āA���w�ɑ����R�����Ƃ��납��n�߂܂��傤�B
�ʂ̃T�C�g�ł��Amol�ɂ��Ă̋L���������܂����I
�����ƍӂ������͋C�ŏ����Ă���̂ŁA��������������������I
mol(����)�̑O�ɁA���w���Ȃ̂��b
mol�̘b������O�ɁA�������w�̗��Ȃ̕��K�����܂��傤�B
���̉��w�����ǂ������Ӗ��������̂����v���o���Ă��������B
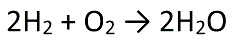
����́A���f���q2�Ǝ_�f���q1����������ƁA�����q2���ł����Ƃ����Ӗ��ł��B
�������ɂ��Ă���W���́A���q�̐���\���Ă��܂��B
�܂肱�̔�������͎�������ƁA�ȉ��̂悤�Ȑ}�ɂȂ�܂��B
mol(����)�Ƃ́A�ȒP�Ɍ����_�[�X�ƈꏏ
�������A���ۂɕ��q��1��2�ȂǂƂ����P�ʂň������Ƃ́A���蓾�܂���B
���q�͂ƂĂ��������̂ł��B
�u���Ă�5000�������Ă���v�Ȃ�Č����Ă��A�S�R�킩��Ȃ��ł���ˁB
����Ɠ����ł��B
���Ă̏ꍇ�́A1���A2���A�Ƃ����悤�����p�I�ȒP���Ő����ĉ������Ă��܂���ˁB
���q�̏ꍇ�ɗp��������p�I�ȒP�ʂ�mol�ł��B
mol�Ƃ́A�ȒP�Ɍ����Ή��M�̃_�[�X�̂悤�Ȃ��́B
���M�̓o�����肵�Ă��邱�Ƃ͏��Ȃ��A12�{��1�_�[�X�Ƃ��Đ����܂��B
����Ɠ��l�ɁA���q�͖�600,000,000,000,000,000,000,000��1mol�Ƃ��Đ����܂��B
����܂�ɂ������̂ŁA�T���ɂȂ��Ă��܂��܂��B
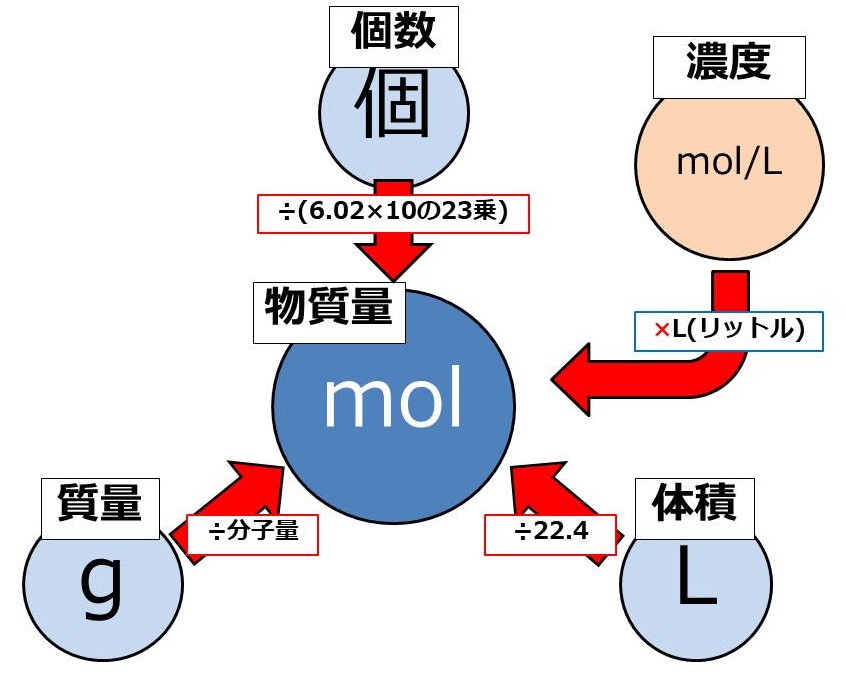
���w����mol
�����ŁA����̉��w���ɖ߂�܂��傤�B
���f���q2�Ǝ_�f���q1����A�����q��2�������鎮�B
���̕��q�𑝂₹�ΐ����q���ǂ�ǂ��Ă����܂��B
�܂�������łǂ�ǂ����Ă����Ƃ������Ƃł��B
mol�͐��̒P�ʂł�����A���f���q2mol�Ǝ_�f���q1mol����A�����q2mol���ł��܂��B
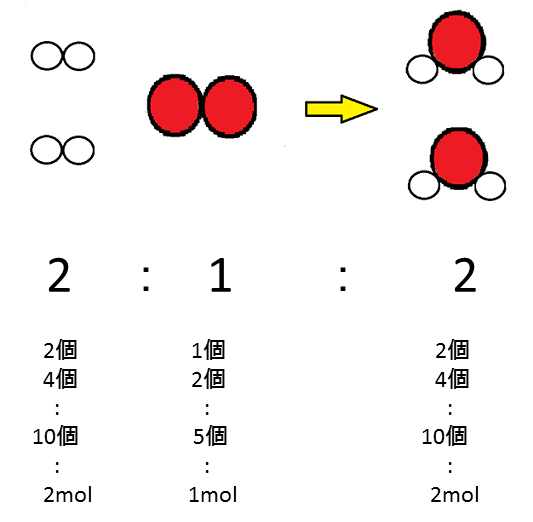
���̂悤��mol(����)�Ƃ́A�܂Ƃ܂������q�̏W�܂�̒P�ʂ�\���Ă��܂��B
�܂����̏W�܂�̐��́A�����������m�Ȑ��ŕ\������܂��B

mol(����)���{�Ȃ�A���ʂȂǂ��{
�Ă�1�U����2�U�ɑ�������A���̏d����2�{�ɂȂ�܂���ˁB
���q�ɂ��Ă��A����������Ƃ������܂��B
�܂�Amol(����)���{�ɂȂ�A���ʂȂǂ��{�ɂȂ�܂��B
���q1mol������̎��ʂ̂��Ƃ��A���q�ʂƂ����܂��B
���̕ӂ�ɂ��Ắumol�ƕ��q�ʂ̊W�v��umol�i�����j�̌v�Z�ƌ����@�`���o�ŊȒP�ɍl���鉻�w�`�v�ŏڂ�����������Ă��܂��B
�����͂����|���Ȃ�
���ꂪmol�̑�̂̍l�����ł��B
mol���ĉ��������c�Ǝv������A��1�U�����炢�̕��q��z�����Ă��������B
(���ۂɂ͂����Ƒ����ł�����ǂ�)
���ɂȂ�O�ɁA���ނ��̂��I�X�X��
���w��mol�̒P���ŋl�܂��Ă��܂��ƁA���̐�̉��w�̓��e���S�R�킩��Ȃ��Ȃ��Ă��܂��܂��B
�����āA���w�������ɂȂ��Ă��܂��̂ł��B
�����Ȃ�O�ɁA�w�Z�����킩��₷���āA�ȒP�ȋ����ŕ����Ă������Ƃ����X�X�����܂��B
�L�����ɂȂ��Ă��܂��Ă���ł́A��x��ɂȂ��Ă��܂��\��������܂��B
�w�Ƃ��Ă��₳�������w��b�x�Ƃ������ނ́A���w�����Ȑl�����ɍ��ꂽ�Q�l���ł��B
���w�A�����M�[�̐l�ł��킩��悤�ɁA�₳����������Ă��܂��B
���Ј�x�A�̂����Ă݂Ă��������B
�Ђ���Ƃ���ƁA�����Ȃ艻�w�����ӂɂȂ��Ă��܂���������܂���B
 |
|